7月25日��,美國生物醫(yī)藥公司Checkpoint Therapeutics在其官網(wǎng)宣布���,公司核心項(xiàng)目PD-L1抗體藥物--Cosibelimab重新提交的BLA申請已被FDA受理,適應(yīng)癥為治療不適合進(jìn)行根治性手術(shù)或根治性放療的轉(zhuǎn)移性或局部晚期皮膚鱗狀細(xì)胞癌(cSCC)成人患者��,PDUFA日期為2024年12月28日���。
7月25日,美國生物醫(yī)藥公司Checkpoint Therapeutics在其官網(wǎng)宣布���,公司核心項(xiàng)目PD-L1抗體藥物--Cosibelimab 重新提交的BLA申請已被FDA受理�,適應(yīng)癥為治療不適合進(jìn)行根治性手術(shù)或根治性放療的轉(zhuǎn)移性或局部晚期皮膚鱗狀細(xì)胞癌(cSCC)成人患者,PDUFA日期為2024年12月28日���。此前2023年12月�,F(xiàn)DA曾因第三方合同制造組織(CMO)制造問題拒絕了Cosibelimab的BLA�,但并未對Cosibelimab的臨床數(shù)據(jù)包、安全性以及說明書表示任何擔(dān)憂��。
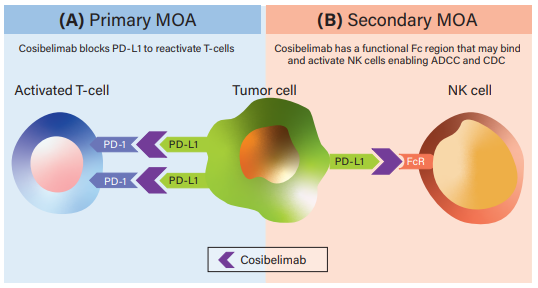
Cosibelimab是一款高親和力��、全人源化IgG1亞型單克隆抗體�,其作用機(jī)制主要體現(xiàn)在兩個(gè)方面:一是可直接結(jié)合PD-L1并阻斷PD-L1與PD-1和B7.1受體的相互作用。從而消除PD-L1對抗腫瘤CD8+T細(xì)胞的抑制作用���,從而恢復(fù)細(xì)胞毒性T細(xì)胞反應(yīng)���;二是Cosibelimab具有功能性Fc結(jié)構(gòu)域,可能能夠誘導(dǎo)針對腫瘤細(xì)胞的抗體依賴性細(xì)胞毒性(ADCC)和補(bǔ)體依賴性細(xì)胞毒性(CDC)�����。
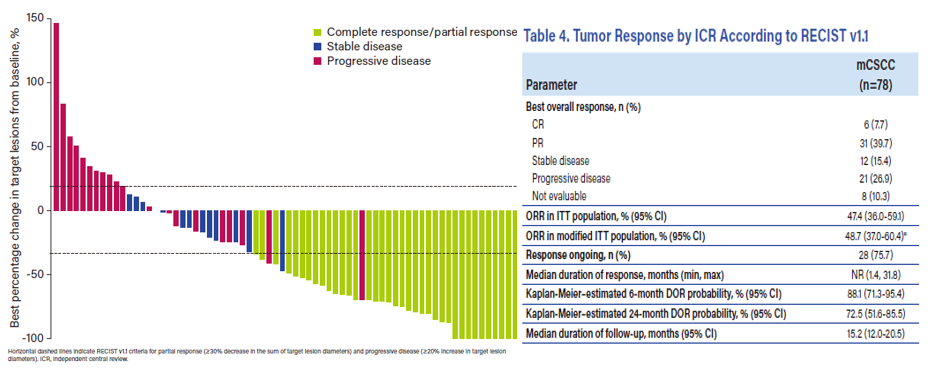
Cosibelimab治療皮膚鱗狀細(xì)胞癌的臨床數(shù)據(jù)早在2022年已報(bào)道����,研究共納入了78名mCSCC患者�,確認(rèn)客觀緩解率(ORR)為47.4%(95% CI:36.0���,59.1)���。2022年6月,臨床中期分析結(jié)果��,根據(jù)對隊(duì)列中31名患者的獨(dú)立中央審查����,確認(rèn)ORR為54.8%(95% CI:36.0,72.7)��,超過了95%雙側(cè)置信區(qū)間25%的臨床意義下限���。
參考文獻(xiàn):
1. 2022年ASCO:Efficacy and Safety of Cosibelimab, an Anti–PD-L1 Antibody, in Patients With Metastatic Cutaneous Squamous Cell Carcinoma: Results From Pivotal Cohort
2.https://ir.checkpointtx.com/news-events/press-releases/detail/93/checkpoint-therapeutics-submits-biologics-license
如果這篇文章侵犯了您的權(quán)利��,請聯(lián)系我們����。




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2024 上海博華國際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57