7月24日�����,CDE官方顯示�,默沙東提交注射用MK-1022的臨床試驗(yàn)申請(qǐng)獲得受理。

MK-1022(第一三共研發(fā)代號(hào)HER3-DXd�,Patritumab deruxtecan)是一款采用第一三共技術(shù)設(shè)計(jì)的潛在first-in-class靶向HER3的ADC�����,由全人源化抗HER3 IgG1單克隆抗體通過可裂解四肽連接子與拓?fù)洚悩?gòu)酶I抑制劑有效載荷(一種依喜替康衍生物��,DXd)連接組成�����。
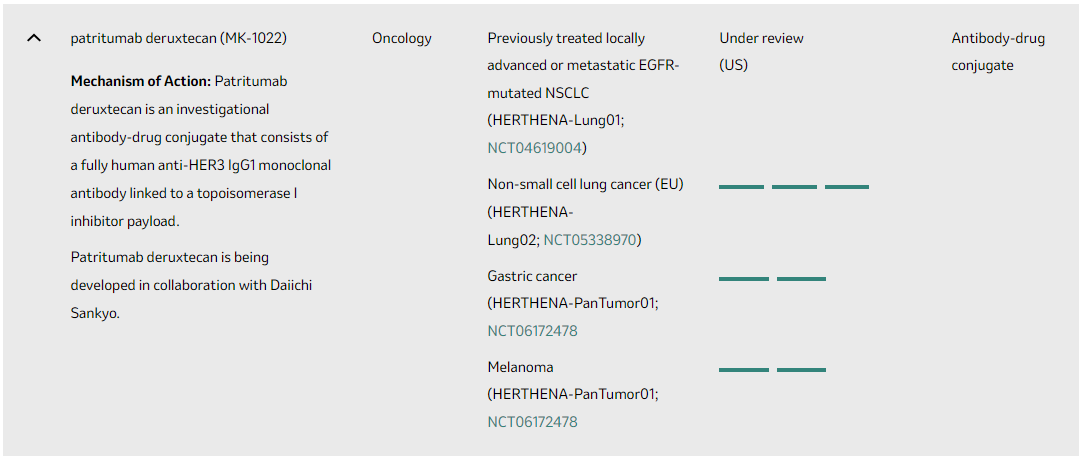
2023年12月22日,第一三共與默沙東聯(lián)合宣布��,美國(guó)食品藥品監(jiān)督管理局(FDA)已經(jīng)對(duì)Patritumab deruxtecan的生物制品許可申請(qǐng)(BLA)進(jìn)行了快速通道審查��,該藥物旨在為那些已經(jīng)嘗試過至少兩種不同全身性治療方案但病情仍處于局部晚期或轉(zhuǎn)移性階段的EGFR基因突變非小細(xì)胞肺癌(NSCLC)患者提供新的治療選擇�。
該藥物的最終審批日期被定在了2024年6月26日。值得注意的是���,這一優(yōu)先審查是基于FDA在2021年12月對(duì)該藥物授予的“突破性療法”認(rèn)定�。盡管在2023年6月26日�����,由于生產(chǎn)合作伙伴的問題�,Patritumab deruxtecan的審批進(jìn)程遭遇了暫時(shí)的延誤�,但根據(jù)現(xiàn)有的臨床數(shù)據(jù)�,該藥物的療效和安全性均得到了充分的驗(yàn)證。
BLA基于HERTHENA-Lung01研究結(jié)果:HER3-DXd對(duì)225例既往接受EGFR TKI和含鉑化療后出現(xiàn)病情進(jìn)展的EGFR突變局部晚期或轉(zhuǎn)移性NSCLC患者產(chǎn)生持久且具有臨床意義的療效�����,客觀緩解率(ORR)為29.8%(95% CI:23.9~36.2)���,其中包含1例完全緩解(CR)����,66例部分緩解(PR)��。此外�,中位緩解持續(xù)時(shí)間(DOR)為 6.4 個(gè)月(95% CI,4.9-7.8)����,中位無進(jìn)展生存期(PFS)為 5.5 個(gè)月(95% CI,5.1-5.9)���。
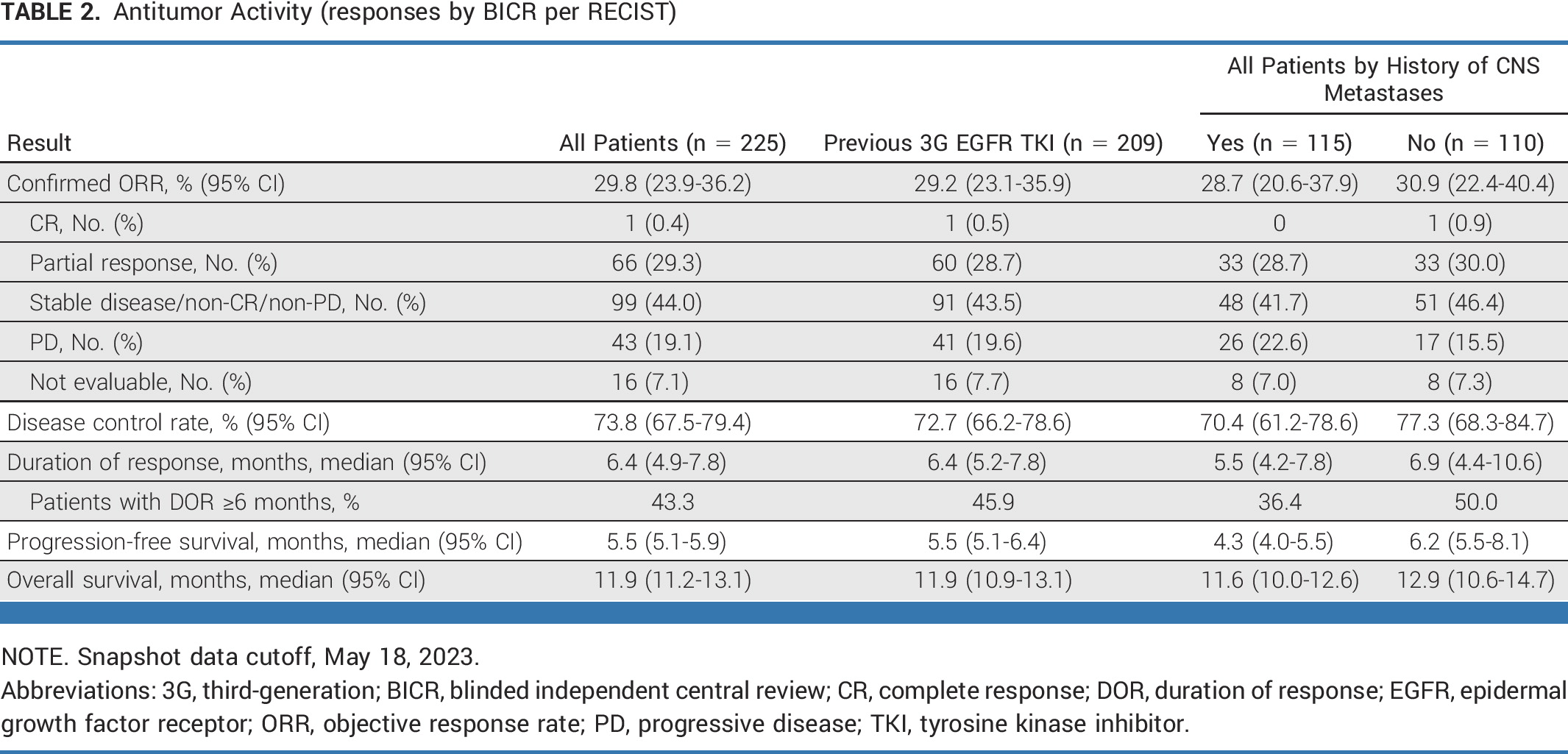
抗腫瘤活性
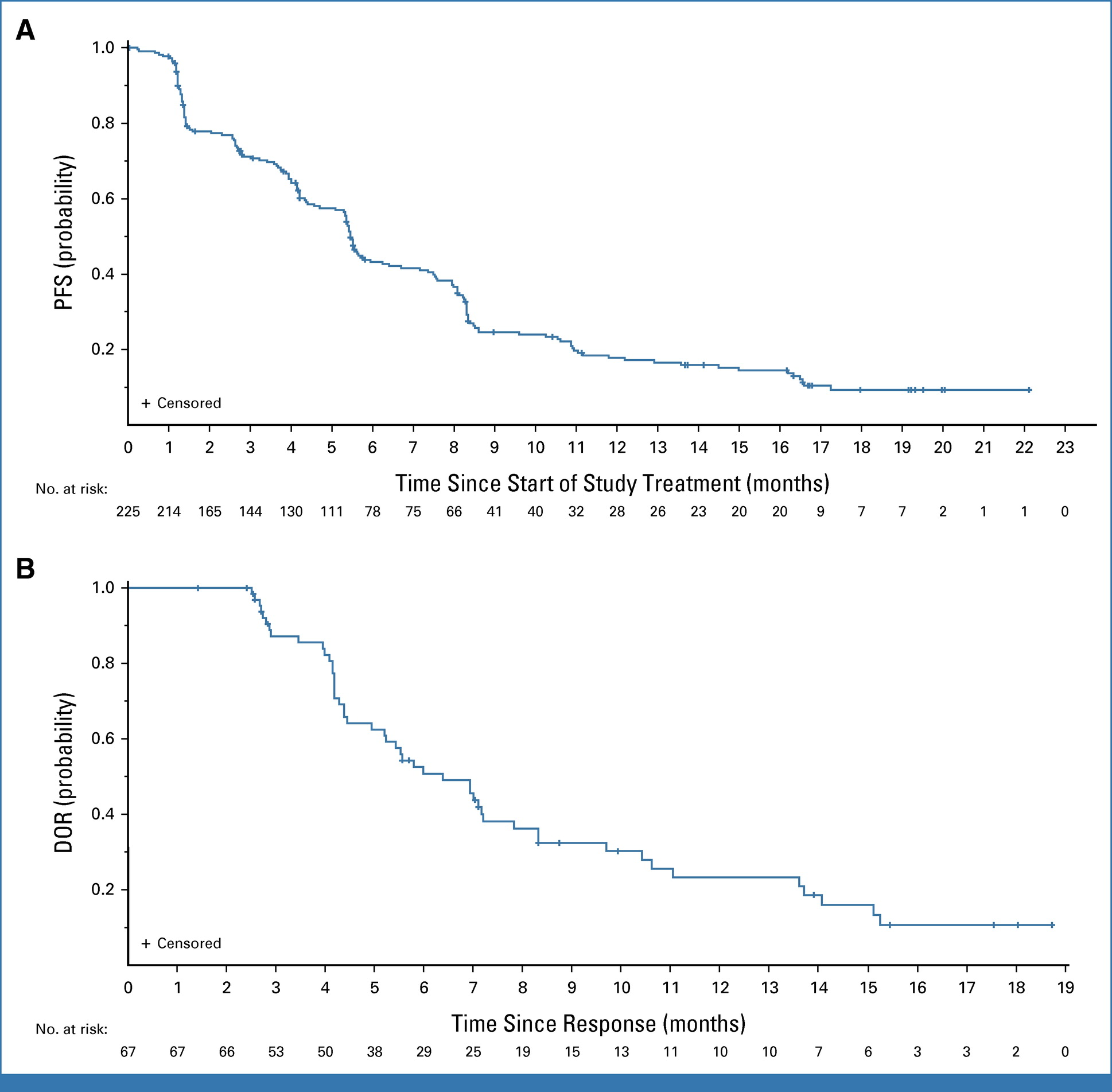
(A)PFS 和(B)DOR 的 Kaplan-Meier 圖
安全性方面��,因治療中出現(xiàn)的不良事件(TEAE)導(dǎo)致終止治療的患者比例較低(7.1%)���。3級(jí)或3級(jí)以上的TEAE發(fā)生率為64.9%����。
同時(shí)���,Patritumab Deruxtecan還正在開展與鉑類化療在EGFR TKI治療失敗后的轉(zhuǎn)移性或局部晚期EGFRm NSCLC中的療效研究(NCT05338970)和局部晚期或轉(zhuǎn)移性實(shí)體腫瘤患者中 HER3-DXd 的研究(胃癌和黑色素瘤���,NCT06172478)。
資料來源:
1.CDE官網(wǎng)
2.默沙東官網(wǎng)








![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57